Kontaktkorrosion, Bimetallkorrosion DIN EN ISO 8044 ist eine elektrochemische Reaktion zweier verschiedener Werkstoffe. Trends wie Elektrifizierung, Energie effizienter zu nutzen, Leichtbau und Verzicht auf die Verwendung bestimmter gefährlicher Stoffe (ROHS-Konformität) führen zu einer stetig zunehmenden Werkstoffvielfalt. Neue Werkstoffkombinationen schaffen auch neue Herausforderungen hinsichtlich der Vermeidung von Kontaktkorrosion. Nachfolgend einige Hinweise zur Bewertung der Kontaktkorrosion von Werkstoffkonzepten.
Elektrochemie und ihr Nutzen
In Batterie-elektrischen Speichern oder Akkumulatoren wie z.B. der Starter-Batterie im Fahrzeug wird die Elektrochemie gezielt eingesetzt um Energie zu speichern und bei Bedarf bereit zu stellen. Diese galvanische Zelle erzeugt elektrische Spannung und damit einen Stromfluss durch chemische Reaktionen. Werkstoffe mit unterschiedlichem elektrochemischen Charakter/Potential reagieren.
Die Elektrochemie wird auch eingesetzt um Bauteile zu beschichten: Die galvanische Beschichtung.
Opferanoden werden zur Korrosionsvermeidung eingesetzt z.B. in der Schiffsfahrt und in Heizkesseln. Der kathodische Korrosionsschutz wird jedoch häufig durch den wartungsfreien elektrischen Korrosionsschutz ersetzt.
Kontaktkorrosion
Gerade die typischen Leichtbauwerkstoffe wie Aluminium oder Magnesium haben auch einen elektrochemisch negativen Charakter. Damit neigen diese Werkstoffe zur Abgabe von Elektronen und Bildung von Ionen. Kombiniert mit edleren Stoffen neigen sie dazu sich aufzulösen.
Deshalb bewerten wir beim Einsatz von Aluminium als elektrischer Leiter oder Magnesium als Leichtbau-Werkstoff die Kontaktkorrosion. Kann das Auftreten eines Elektrolyten nicht ausgeschlossen werden, ist die Bewertung der Werkstoffe auch hinsichtlich Kontaktkorrosion sinnvoll. Durch ein geeignetes Design oder Vermeidungsmaßnahmen wird die Korrosion vermieden.
Anforderungen an das Design sind beispielsweise die Verwendung von Kontaktmaterialien, die von derselben Art sind oder in der galvanischen Spannungsreihe möglichst nahe beieinander liegen. Ist die Potentialdifferenz zu groß bei Vorhandensein eines Elektrolyten sind Änderungen oder Korrosionsschutzmaßnahmen erforderlich.
Für die Flächenanteile gilt die Regel Kathodenfläche << Anodenfläche, d.h. die Kathodenfläche mit dem edleren Metall sollte deutlich kleiner als die Anodenfläche sein. So sollten beispielsweise unedlere Verbindungselemente vermieden werden.
Falls diese Anforderungen nicht technisch möglich sind, sind Korrosionsschutzmaßnahmen erforderlich z.B. die Isolation der Metalle oder die Abdichtung gegen potentielle Elektrolyten. Wichtig ist dabei auch der Nachweis der Langzeitstabilität.
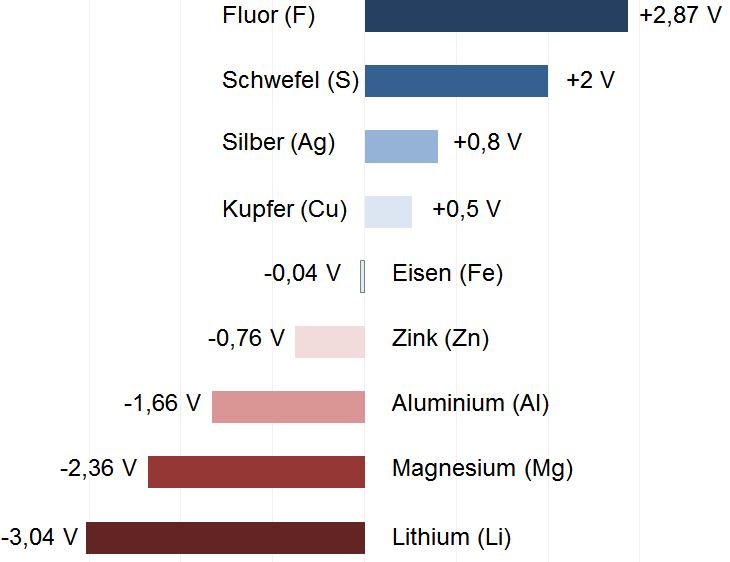
Die Spannungsreihe verschiedener Metalle (Standardpotentiale gegen Wasserstoff). Elemente suchen einen energetisch günstigen und stabilen Zustand. Dies kann zu ungewollten chemischen Reaktionen führen. Gerade die Leichtbauwerkstoffe Aluminium oder Magnesium sind hier anfällig. Eine Bewertung des Designs zur Vermeidung der Kontaktkorrosion ist sinnvoll.
Beispiele von Werkstoffpaarungen die bereits zu Problemen führten
- Aluminiumblech, Profil-Trapezblech auf Stahlstruktur unter Feuchtigkeit
- Aluminium Befestigungsschraube in Stahlstruktur unter Kondenswasserbildung, Feuchtigkeit, Salzwasser, Wasser und Streusalz
- Kupfer-Aluminium-Verbindung ist ein Elektrolyt vorhanden, muss die Übergangsstelle gegen Elektrolyt abgedichtet werden
- elektrische Steckverbindungen mit Zinnbeschichtung in Kombination mit Steckverbindungen mit Goldbeschichtungen unter Feuchtigkeit, Säurebildung
- Kupfer und verzinkte Befestigungselemente (ist ein Elektrolyt vorhanden ist Zink als Korrosionsschutz auf Stahl in der Verbindung mit Kupfer ungeeignet. Gefahr besteht auch bei unzureichend gekennzeichneter Beschichtungen und Vertauschen verzinnter und vernickelter Crimpverbindungen.
- Kohlenstofffaserverstärkte Kunststoffe (CFK) mit Inserts aus Stahl oder Aluminium unter Feuchtigkeit

Kontaktkorrosion an einem einfachen Beispiel: Verzinkte Verbindungselemente in Kupfer.
Die obere Abbildung zeigt den Aufbau von Stromschienen aus Kupfer, verschraubt mit einer verzinkten Stahlschraube. Die Probe wurde partiell in 10%-ige Salzwasser-Lösung (Elektrolyt) eingetaucht, von Luftsauerstoff zugänglich.
Die untere Abbildung zeigt dieselbe Probe nach 24 h in Salzwasser. Das Zink wurde vollständig aufgelöst, flächige Rotrostbildung setzt ein.
Fazit: Ist ein Elektrolyt vorhanden ist Zink als Korrosionsschutz auf Stahl in der Verbindung mit Kupfer ungeeignet.
Profitieren Sie von unserem Know-How in den Bereichen Erstellung von Design-Lösungen und Bewertung von Werkstoffkonzepten. Weitere Information erhalten Sie gerne in einem unverbindlichen und persönlichen Gespräch:
Link zur Kontakt-Seite
